摘 要: 目的 建立液相色谱串联质谱法测定人血浆中克拉霉素的浓度。方法 选用ACQUITY UPLC BEH C18柱 (2.1×50mm, 1.7μm) 的色谱柱, 以含0.1%的甲酸纯水, 含0.1%的甲酸95%乙腈为流动相, 采用梯度洗脱进行分离, 样本经蛋白沉淀及30%乙腈复溶后进样, 选用API4000型质谱仪的多重反应监测 (MRM) 扫描方式进行检测。结果 克拉霉素线性范围为4.00~2 000.00ng/mL, 定量下限4.00ng/mL。准确度与精密度结果显相对偏差为1.20%~2.90%, 低、中、高3个浓度提取回收率平均值均大于100%, 基质效应小, 稳定性好。结论 该方法快速、灵敏、专属性强、重现性好, 可用于人体克拉霉素血药浓度的监测及人体药代动力学研究。
关键词: 高效液相色谱-质谱联用法; 克拉霉素; 药代动力学; 血药浓度监测;
Abstract: Objective To establish the liquid chromatography-tandem mass spectrometry method to measure concentration of clarithromycin in human plasma.Methods ACQUITY UPLC BEH C18 chromatographic column (2.1×50 mm, 1.7μm) was adopted.The pure water with 0.1% methanoic acid and 95% acetonitrile with 0.1% methanoic acid were used as mobile phase.Then, samples were separated by gradient elution, and processed by protein precipitation and 30% acetonitrile dissolution.After that, samples were detected with multiple reaction monitoring (MRM) scanning method of API4000 mass spectrometer.Results The linear range of clarithromycin was 4.00-2 000.00 ng/mL, and the lower limit of quantification was 4.00 ng/mL.The relative deviation in accuracy and precision fell between 1.20%-2.90%.The average recovery rate of clarithromycin was more than 100% respectively at low, medium and high concentration.The matrix effect was small and the stability was good.Conclusion The method is rapid and sensitive with good specificity and good specificity.It can be used to monitor concentration of clarithromycin in human plasma and study human pharmacokinetics.
Keyword: liquid chromatography-tandem mass spectrometry; clarithromycin; pharmacokinetics; therapeutic drug monitoring;
克拉霉素属14元环大环内酯类抗菌药物, 抗菌谱与红霉素、罗红霉素等相同, 但对革兰阳性菌如链球菌属、肺炎球菌、葡萄球菌的抗菌作用略优, 且对诱导产生的红霉素耐药菌株亦具一定抗菌活性, 抗菌活性强[1,2,3,4]。环内酯类抗菌药物是一类弱碱性、亲脂性抗菌药物, 具有抗菌谱广、疗效显着、耐受性好等优点[5]。该品对淋球菌、李斯特菌、空肠弯曲菌也有一定作用, 而对嗜肺军团菌、肺炎支原体、沙眼衣原体、溶脲脲原体等的作用比红霉素强, 同时克拉霉素生物利用度高, 约是红霉素生物利用度的2倍[6,7]。本药特点为在体外抗菌活性与红霉素相似, 但在体内对部分细菌如金黄色葡萄球菌、链球菌、幽门螺杆菌等抗菌活性比红霉素强, 与红霉素之间有交叉耐药性[8,9,10]。本研究使用内标法, 因其在液相色谱串联质谱 (LC-MS/MS) 法生物样品定量分析时被广泛使用, 具有灵敏度高、准确性好的优点, 它可以补偿检测过程中待测物在样品准备、色谱分离和信号响应等方面的损失或变化, 使定量结果更加准确[11,12]。用LC-MS/MS法监测人体中的血药浓度或进行药代动力学研究, 高效液相色谱是一种准确度高、分离范围广的快速分离方法, 它对化合物的结构破坏性小, 适合有机分子和生物分子的分离。质谱具有其他分析方法无可比拟的灵敏度, 对于未知化合物的结构分析定性十分准确, 对相应的标准样品要求也比较低[13]。本实验目的是采用LC-MS/MS法测定人血浆中克拉霉素的浓度, 研究克拉霉素片剂在人体中的药物代谢动力学, 计算药物代谢动力学参数。本实验采用一步沉淀法, 建立了血浆中克拉霉素LC-MS/MS快速定量方法, 样本前处理直接简便、成本低, 可用于人体克拉霉素血药浓度的监测及药代动力学研究。
1、 材料与方法
1.1、 仪器与试剂
盐酸克拉霉素对照品 (TCL) , 内标克拉霉素-13C-d3 (TCL) , 甲醇、乙腈为色谱级 (Merck) , 水和甲酸为质谱级 (Fisher) 。ACQUITY UPLC BEH C18 (2.1×50mm, 1.7μm, 美国Waters公司) 色谱柱。API4000型液相色谱-串联质谱仪, 配有电喷雾离子化源 (ESI) , 以及Analyst 1.6.2数据处理软件 (美国Applied Biosystem公司) 。高效液相色谱系统, 包括二元输液泵、自动进样器、切换阀 (日本岛津公司) 。
1.2、 方法
1.2.1、 储备液配制
精密称取5.62mg盐酸克拉霉素 (纯度为98.1%) 对照品, 置于8mL容量瓶中, 并用100%甲醇溶解定容, 配制成1.00mg/mL的克拉霉素储备液。
1.2.2、 标准曲线溶液配制
精密量取克拉霉素储备液适量, 用50%甲醇稀释至标准曲线浓度, 分别为4.00、8.00、20.00、100.00、400.00、1 200.00、1 800.00、2 000.00ng/mL。精密量取克拉霉素储备液适量, 50%甲醇稀释至质控样本浓度, 分别为定量下限4.00ng/mL, 低浓度12.00ng/mL, 中浓度1 000.00ng/mL, 高浓度1 600.00ng/mL。
1.2.3、 内标溶液配制
精密称取克拉霉素-13 C-d3 (纯度为98.6%) 对照品1.00mg, 置于2mL透明玻璃瓶中, 并用100%甲醇溶解, 配制成1.00mg/mL的克拉霉素-13 C-d3储备液, 取适量储备液用50%甲醇稀释至浓度100.00ng/mL。
1.2.4、 色谱柱
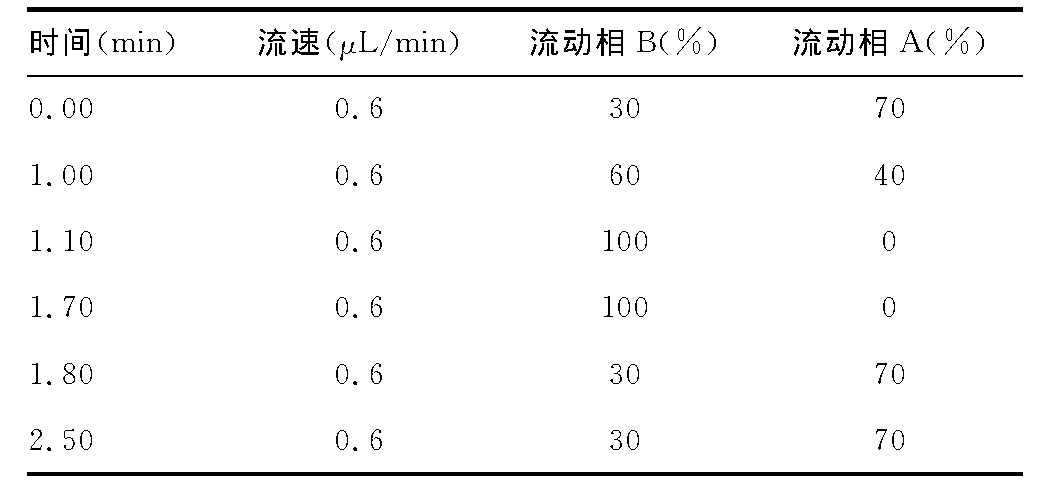
ACQUITY UPLC BEH C18 (2.1×50mm, 1.7μm) Waters;流动相A:纯水含0.1%的甲酸, 流动相B:95%乙腈含0.1%的甲酸, 洗针液为100%乙腈, 梯度洗脱程序 (见表1) ;流速:0.6mL/min;柱温:40℃;进样量:5μL。
1.2.5、 离子源
电喷雾离子化源;正离子模式;扫描方式为多重反应监测 (MRM) ;离子喷射电压 (IS) :4 500V;温度 (TEM) :500℃;雾化气 (GS1) :310kPa;辅助气 (GS2) :345kPa;气帘气 (CUR) :207kPa;碰撞气 (CAD) :6.00unit;入口电压 (EP) :10.00V;出口电压 (CXP) :15.00V;去簇电压 (DP) :80.00V;碰撞能量 (CE) :40eV;克拉霉素、克拉霉素-13 C-d3用于定量分析的离子反应分别为质荷比 (m/z) 748.5~158.1和m/z 752.5~162.1;克拉霉素用于定性分析的离子反应为m/z 748.5~158.1。
表1 梯度条件
1.2.6、 血浆样品处理
精密量取克拉霉素血浆样品50μL、加入内标克拉霉素-13 C-d3溶液50μL、加入沉淀剂乙腈300μL、涡旋10min、以4℃离心10 min (4 000r/min) , 取50μL上清液加450μL 30%乙腈复溶摇匀后进样, 用LC-MS/MS定量分析, 进样量5μL。
1.2.7、 特异性检测
分别使用空白血浆、空白血浆加入克拉霉素及内标系列溶液, 按“血浆样品处理”项操作, 进行质谱分析。
1.2.8、 线性关系
采用相同批次的空白血浆制备标准曲线样本。用空白血浆及标准曲线工作溶液制备8个浓度水平的标准曲线样本。对理论浓度与实际值 (待测物与内标峰面积比值) 进行线性回归, 采用最小二乘法对标准曲线所有浓度点进行拟合, 权重因子为1/x2, 在整个试验中保持一致。
1.2.9、 提取回收率和基质效应
将常规基质作为空白对照样本, 向该对照样本中添加待测物和内标按照血浆样品处理制得低、中和高浓度样本。制备与上述测试样本具备相同理论浓度纯溶液 (待测物及内标) 作为参比溶液。以每一浓度所测得峰面积比值计算基质效应。按照血浆样品处理制克拉霉素低、中、高浓度的3个血浆样本, 每一浓度3个样本分析, 得到色谱图并计算峰面积。
1.2.1、 0 稳定性检测
使用低浓度样本和高浓度样本进行稳定性。考察条件分别为人血浆样本在室温条件下的稳定性、人血浆样本在-20℃和-80℃条件下的长期稳定性、对于人血浆样本在-80℃条件下的冻融循环稳定性。
2、 结果
2.1、 质谱分析
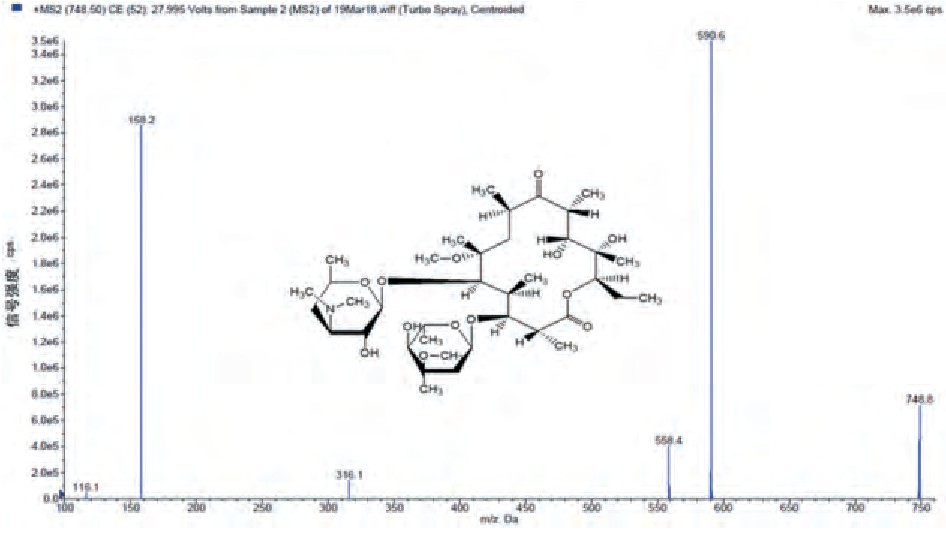
将克拉霉素、克拉霉素-13 C-d3用乙腈稀释至5ng/mL, 采用针泵进样, 进行碎片离子分析, 相应的扫描质谱图见图1、2。
2.2、 特异性
经质谱分析, 克拉霉素和内标克拉霉素-13C-d3的保留时间为1.00min左右, 单个样本的测试时间为2.50min。见图3。结果表明, 内源性物质不干扰待测物和内标。
图1 克拉霉素扫描质谱图
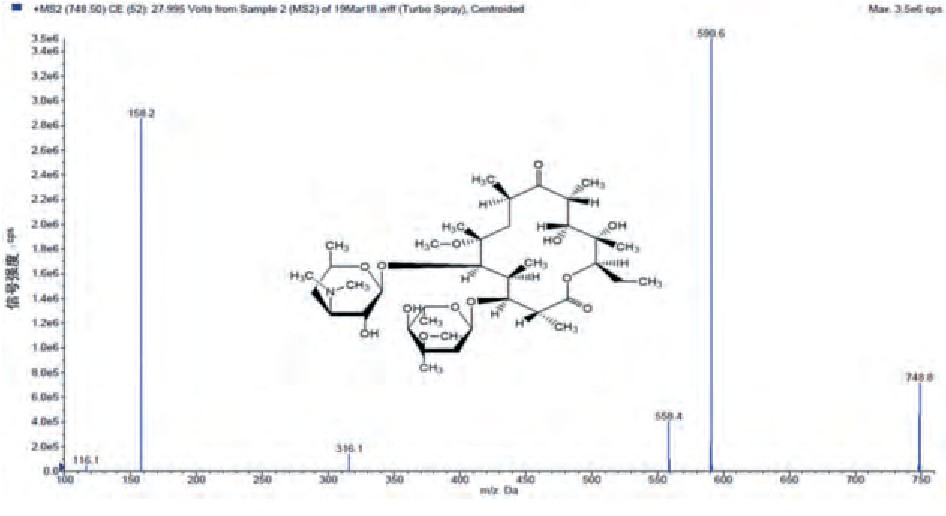
图2 克拉霉素-13 C-d3扫描质谱图
2.3、 准确度与精密度
采用质控样本 (4.00、12.00、1 000.00、1 600.00ng/mL) 评估待测样本精密度和准确度, 考察次数为3次。结果如表2。
2.4、 提取回收率和基质效应
克拉霉素、克拉霉素-13C-d3的基质效应为:低浓度 (97.1±2.2) %、中浓度 (99.9±1.1) %、高浓度 (99.1±1.3) %。低、中、高3种浓度的提取回收率分别为 (101.4±1.4) %、 (101.0±1.7) %、 (102.0±0.8) %。内标克拉霉素-13C-d3的平均提取回收率为 (96.9±2.4) %。结果表明, 血样中克拉霉素、克拉霉素-13 C-d3提取回收率均较高且稳定, 血样中基质对克拉霉素、克拉霉素-13 C-d3的基质效应均较小。
图3 LC-MS/MS测定人血浆中克拉霉素和内标克拉霉素-13 C-d3的典型MRM离子流图
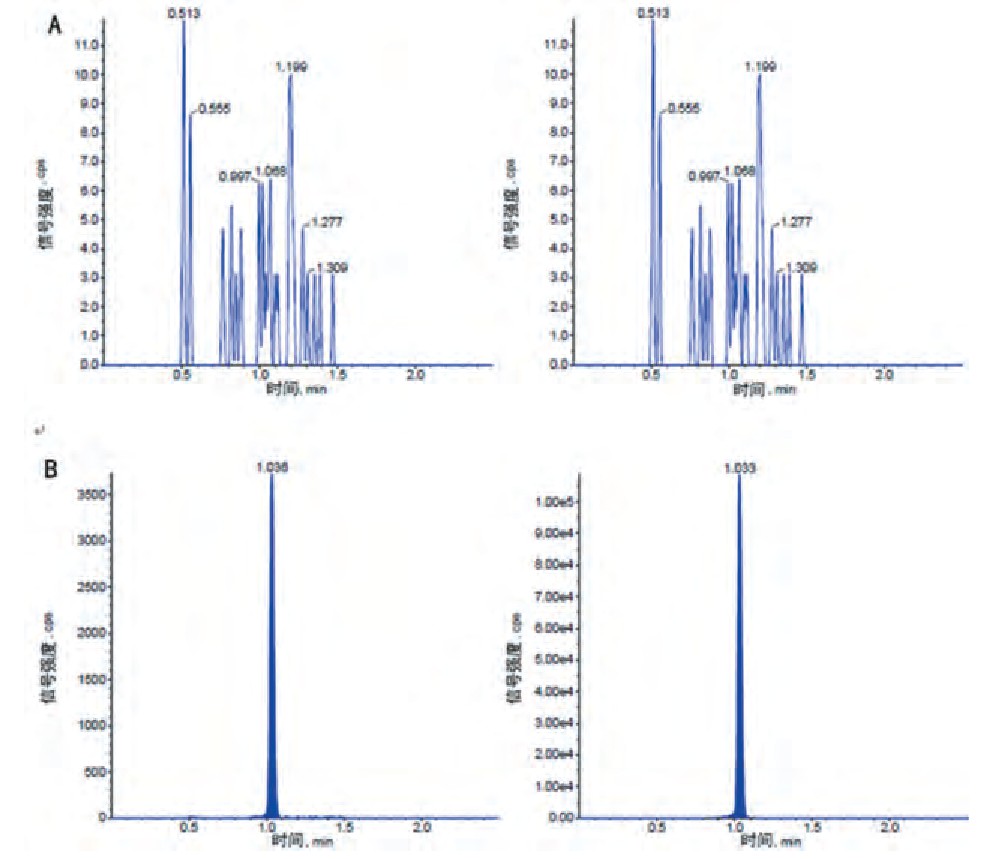
注:A为空白血浆样本离子流图;B为空白血浆加入4.00ng/mL克拉霉素溶液和100.00ng/mL内标克拉霉素-13C-d3溶液的离子流图
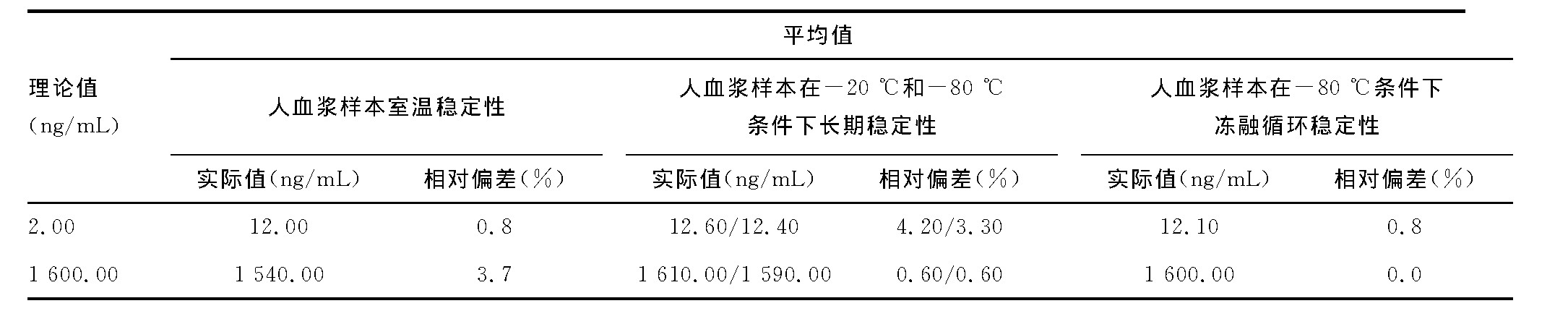
2.5、 稳定性
人血浆室温稳定性考察时间为12h, -80℃冻融循环次数为3次, -20℃和-80℃长期稳定时间为30d。测试结果见表3。待测物克拉霉素在3种条件下稳定性良好。
表2 血浆克拉霉素LC-MS/MS测定方法的准确度与精密度
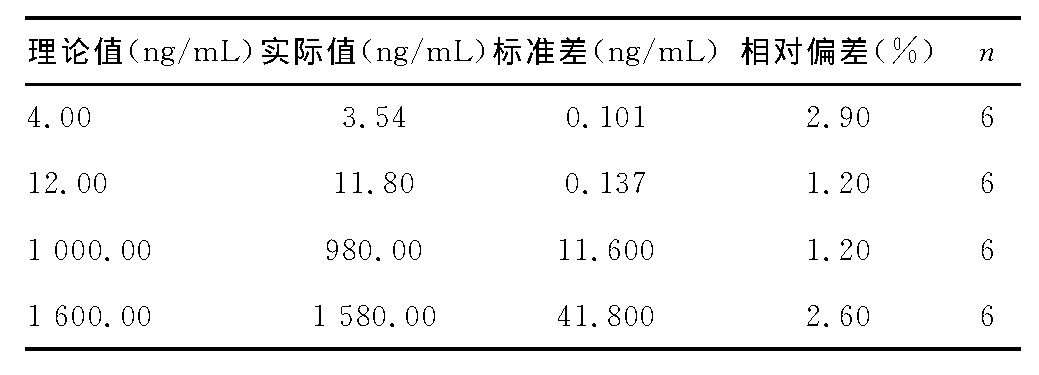
表3 克拉霉素LC-MS/MS测定方法的3种稳定性考察结果
3、 讨论
本实验在不会影响到灵敏度的前提下, 血浆样本的前处理过程采用了极其简洁方便的一步沉淀蛋白法, 尽可能地缩短了前处理过程所用时间, 提高了整个实验的效率。待测物克拉霉素在C18色谱柱上保留较强, ACQUITY UPLC BEH C18色谱柱粒径小, 分离度较好, 可增加塔板数, 较少分离时间。采用95%乙腈含0.1%甲酸溶液梯度洗脱可以得到较好并且稳定的分离效果, 有机相和水相都加入甲酸使得基线更加平稳, 减少基质抑制并提高信噪比并且可以改善峰形。采用梯度洗脱可以得到峰形良好的色谱峰, 缩短质谱分析时间。研究发现, 克拉霉素在ESI源正离子方式下 (m/z 748.5) 信号高, 使用m/z 748.5作为MRM扫描方式的母离子, 二级碎片扫描时m/z158.1信号高, 故使用m/z 158.1作为子离子进行定量。在梯度洗脱条件下, 内标的选择相对来说比较重要, 内标选用对照品克拉霉素-13 C-d3进行考察, 发现克拉霉素-13C-d3液相条件与克拉霉素基本一致, 峰形极好, 保留时间也相同。由于克拉霉素和内标克拉霉素-13C-d3在1.00min附近出峰, 其余时间段均进入废液, 同时也减少了色谱前沿其他强极性物质的干扰, 在一定程度上减少了基质效应。
4 结论
本研究使用了一步沉淀法并建立了快速定量人血浆中克拉霉素浓度的LC-MS/MS法。此方法单个生物样本使用量少、前处理方便、灵敏度高、分析时间短, 适用于克拉霉素临床药代动力学研究及治疗药物监测。
参考文献:
[1]四川美康医药软件研究开发有限公司.药物临床信息参考 (2006版) [M].成都:四川科学技术出版社, 2006:323-326.
[2]李鹏飞, 孙健姿, 马萍, 等.LC-MS/MS法测定人血浆中克拉霉素的质量浓度[J].北京师范大学学报, 2012, 48 (3) :323-326.
[3]周艳, 高旭光, 王德霞, 等.克拉霉素片处方及工艺研究[J].中国药业, 2012, 21 (4) :42-43.
[4]吕永铭, 冀晓庆.王淑亮.克拉霉素治疗幽门螺杆菌感染患者的临床疗效研究[J].中华医院感染学杂志, 2015 (9) :1997-1998.
[5]崔文平.抗耐药菌克拉霉素衍生物的设计、合成及活性评价[D].青岛:山东大学, 2012.
[6]梁艳, 谢林, 刘晓东, 等.LC-MS法测定人血浆中克拉霉素的浓度[J].中国药科大学学报, 2004, 35 (1) :50-53.
[7]陈家蓉.克拉霉素在呼吸道感染中的临床应用医学信息[J].2008, 21 (9) :1713-1714.
[8] MOLINA-INFANTE J, GISBERT J P.Optimizing clarithromycin-containing therapy for Helicobacter pylori in the era of antibiotic resistance[J].World J Gastroenterol, 2014, 20 (30) :10338-10347.
[9] AHMAD N, ZAKARIA W R, ABDULLAH S A.Characterization of clarithromycin resistance in Malaysian isolates of Helicobacter pylori[J].World J Gastroenterol, 2009, 15 (25) :3161-3165.
[10]FDA Drug Safety Communication:FDA review finds additional data supports the potential for increased longterm risks with antibiotic clarithromycin (Biaxin) in patients with heart disease[J].J Chinese Pharml Sci, 2018, 27 (2) :139-140.
[11]张博, 张贺, 刘思洁.分散微固相萃取-同位素内标法-超高效液相色谱-串联质谱法测定水果中的吗啉[J].食品安全质量检测学报, 2018, 9 (4) :918-924.
[12]李华, 梁超, 张红.HPLC法测定人血浆中克拉霉素片的浓度及其药代动力学研究[J].实用临床医学, 2004, 5 (6) :1-2.
[13]卞宝军, 丁礼琴, 金家骅.HPLC-MS-MS法测定克拉霉素血药浓度的含量[J].上海医药, 2016, 37 (21) :76-79.








